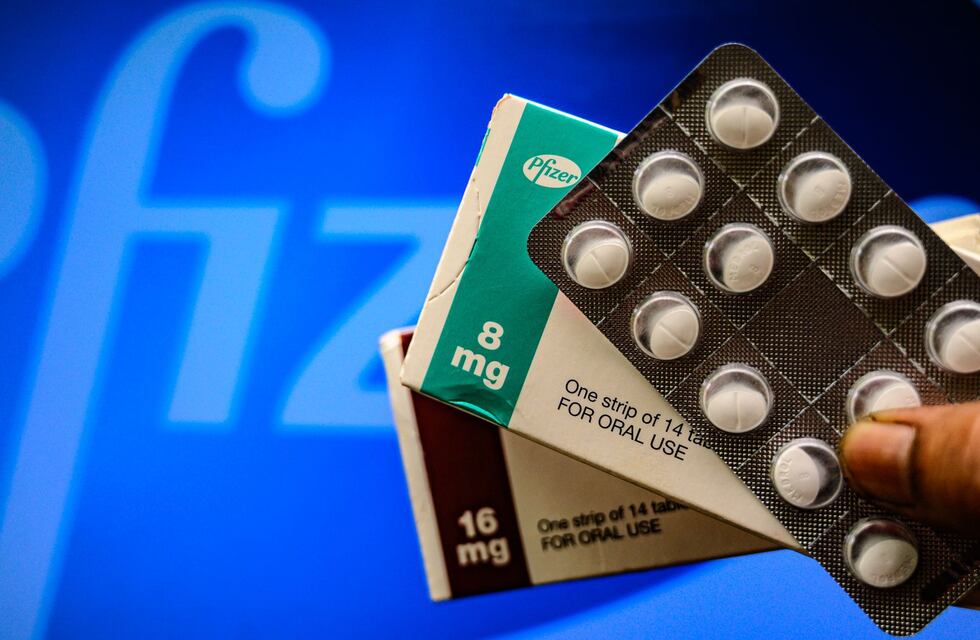
Nuevamente el laboratorio Pfizer es noticia en torno a los anuncios de su píldora contra el COVID-19. De esta manera, reportó que su píldora registró una eficacia del 89% contra las hospitalizaciones en pacientes de alto riesgo, según los estudios que realizaron.

A su vez, Pfizer anunció que su píldora es efectiva contra la variante Ómicron, según análisis de laboratorio.
Por el momento están esperando que las autoridades sanitarias de Estados Unidos comiencen a autorizar el tratamiento a fin de ser aplicado en las personas más vulnerables por la enfermedad.
¿Qué plantea el análisis de Pfizer?
Este martes, la empresa anunció que según sus estudios realizados, la eficacia de su píldora contra el coronavirus, alcanza casi el 90% en lo que respecta a la prevención de hospitalizaciones y fallecimientos en los pacientes de alto riesgo.
A su vez, también hablaron de que la eficacia de esta píldora puede ser aplicada a la variante Ómicron, descubierta en Sudáfrica hace ya varias semanas.
Durante el transcurso del mesa pasado, Pfizer ya había anunciado las bondades de esta píldora para tratar la enfermedad, comparándola con placebos. Estos resultados los obtuvo a través de muestras efectuadas en 2.200 voluntarios.
Cabe mencionar que durante los ensayos médicos realizados por la empresa, no hubo que lamentar ninguna muerte en aquellos pacientes/voluntarios que recibieron el tratamiento ofrecido por Pfizer.
Por el contrario, sí se produjeron 12 muertes en el grupo de pacientes que solo recibieron el placebo.
Los detalles de la píldora de Pfizer
Según detallaron desde el laboratorio, la píldora se debe tomar junto con el antiviral ritonavir cada 12 horas y durante un lapso de cinco días, una vez iniciados los síntomas.
En caso de ser autorizada por las autoridades sanitarias norteamericanas, esta pastilla saldrá al mercado bajo el nombre de Paxlovid.

Al mismo tiempo, Pfizer dio a conocer los datos iniciales de un segundo ensayo clínico que estuve realizando, en donde mostró que pudo reducir las hospitalizaciones de pacientes en un 70% aproximadamente, de una muestra de 600 adultos categorizados como de riesgo estándar.
Mikael Dolsten, director científico de Pfizer, no ocultó su entusiasmo por los logros conseguidos: “Es un resultado sorprendente”.
“Estamos hablando de un número asombroso de vidas salvadas y de hospitalizaciones que se han evitado. Y, por supuesto, si se implementa esto rápidamente después de la infección, es probable que reduzcamos la transmisión de forma drástica”, agregó Dolsten.
La autorización pendiente de los Estados Unidos
Según también expresó el director científico del laboratorio, el mismo se encuentra a la espera de que la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), autoricen el uso de estas pastillas en pacientes de alto riesgo.
“Estamos en negociaciones reguladoras muy avanzadas tanto con Europa como con el Reino Unido, y tenemos conversaciones con la mayoría de las principales agencias reguladoras a nivel mundial”, confirmó Dolsten.

Debemos recordar que en la actualidad no existe ningún tratamiento antiviral de forma oral que esté autorizado en los Estados Unidos contra el COVID-19
Sin embargo, Pfizer ya adelantó que podrá tener listos 180.000 tratamientos para que sean enviados este mismo año y planea aumentar la cifra a 80 millones para el 2022.