El laboratorio de origen estadounidense, Pfizer, este viernes dio a conocer que, tras ensayos clínicos exitosos, su píldora contra el coronavirus podría reducir el riesgo de muerte a causa de esta enfermedad en un 89%.
//Mirá también: Reino Unido: Aprobaron molnupiravir, la primera pastilla antiviral contra el coronavirus
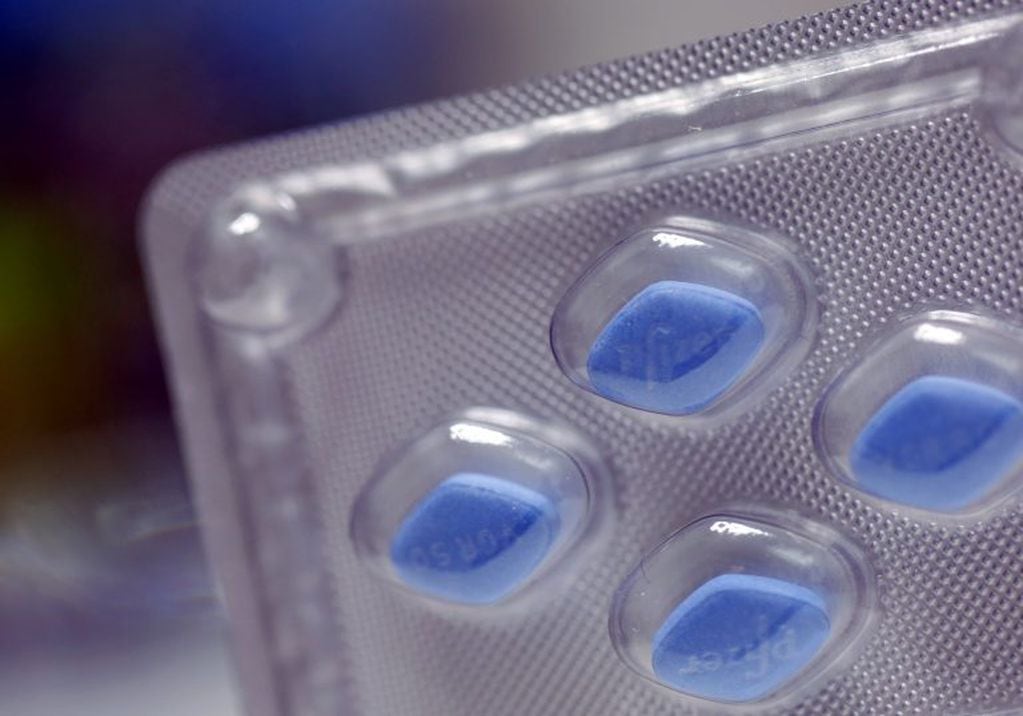
A su vez, bajaría las posibilidades de internación en los pacientes adultos. Según anunciaron desde Pfizer, la pastilla llamada Paxlovid, mostró una alta efectividad en los ensayos clínicos realizados.
Esta píldora es conocida científicamente como PF-07321332, y forma parte de los llamados inhibidores de proteasa, actuando para inhibir la enzima que el virus precisa para poder replicarse en las células humanas.
Hay que mencionar que los inhibidores de proteasa son usados para tratar otras enfermedades virales tales como el HIV y la hepatitis C.
Resultados positivos
Los resultados de los análisis clínicos realizados por Pfizer se enmarcan luego de transcurridas apenas horas del anuncio del Reino Unido, donde se afirmó que el laboratorio MSD aprobó otra pastilla para tratar el COVID-19.
Los resultados del Paxlovid, según informó Pfizer, logran reducir hasta un 89% las posibilidades de internación en adultos mayores así como también la muerte. Del mismo modo, reduce el riesgo de adquirir enfermedades graves producto del contagio de coronavirus.
¿Cómo se hizo el ensayo?
El ensayo realizado por Pfizer llegó a la conclusión de que entre los pacientes que tomaron Paxlovid, junto con otro antiviral -ritonavir- el cual se usa en tratamientos combinados para el HIV, la reducción de hasta un 89% de muertes e internaciones se hizo efectiva, en comparativa con los pacientes que consumieron solo un placebo.
A su vez, mediante un comunicado, los resultados fueron informados a partir de un análisis provisional de los datos recogidos en el ensayo, propios de fase 2 y 3, que se llevaron a cabo de manera randomizada y con un sistema doble ciego.
Este sistema doble ciego significa que ni los investigadores ni los pacientes supieron en principio quiénes recibían la droga experimental y quiénes el placebo.
Dado los resultados altamente positivos, Pfizer ya anunció que dejará de reclutar voluntarios para estos análisis. Asimismo, enviará los datos a la Agencia de Alimentos y Medicamentos de Estados Unidos (FDA), con el finde conseguir la autorización de uso de emergencia.
El director ejecutivo de Pfizer, Albert Bourla afirmó: “La noticia de hoy (por este viernes) es un auténtico cambio en los esfuerzos globales para detener la devastación de esta pandemia”.
Y agregó: “Estos datos sugieren que nuestra candidata antiviral oral, si es aprobada o autorizada por las autoridades reguladoras, tiene el potencial de salvar la vida de los pacientes, reducir la gravedad de las infecciones por COVID-19 y evitar hasta nueve de cada diez hospitalizaciones”.
Los detalles de las pruebas
La cantidad de voluntarios para este ensayo fue de 1.219 adultos tanto de América del Norte, América del Sur, Asia, Europa y África.
También trascendió que Paxlovid fue suministrada a un grupo de personas enfermas dentro de los tres días de comenzados los síntomas de COVID-19. A otro grupo de personas también enfermas se le proveyó la droga a los cinco días del inicio de los síntomas.
Aquellos que fueron tratados a los tres días, solo el 0,8% de los pacientes precisaron ser internados, el equivalente de 3 pacientes de un total de 389, y ninguno falleció a causa del virus. Esto mismo se contabilizó dentro de los primeros 28 días de haber consumido Paxlovid.
En comparación con aquellos que consumieron un placebo, el 7% fueron internados o murieron, lo que equivale a 27 de 385, con siete muertes en total.
Porcentajes similares se dieron con aquellos voluntarios que fueron tratados a los cinco días. Aquí se recabó la información que el 1% que recibieron la droga precisaron ser hospitalizados, seis de 607 y tampoco se registraron muertes.
Y para los tratados con el placebo, la internación fue de un 6,7%, o sea, 41 de 612, con 10 muertes en total.
Medicamento disponible para este año
Así también lo anunciaron, dado que si obtiene la autorización pertinente, el Paxlovid podría estar disponible para dentro de lo que queda de este 2021.
La píldora podría usarse en pacientes ya infectados o también como una medida preventiva (por ejemplo, para evitar que el virus pueda expandirse dentro de un hogar).
Asimismo, los directivos del laboratorio afirmaron que la droga muestra signos de ser altamente efectiva para las distintas variantes del coronavirus. Mikael Dolsten, director científico de Pfizer afirmó: “Es un medicamento realmente importante para el mundo”.







:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/P2GRGHNUQ5A2TCRQKMFXCKMJ4I.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/3TMEF7EIYFAAFMCFORWMZ2T6Q4.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/BETUHDLXDBBVDJ7LZPMYAFIBCU.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/RSTFNZEBQNCFZBJF6HCLPXHN2A.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/JKSSXRKVUNDVLBKUV5UHKTMTFI.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/MNTDCNJVMVTGGYJZG5SDOYZRMY.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/BVFPY26ZFBEERJMDCLCC3NWGO4.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/IGFM7JV6CVFAFHXYWTUTTYZTSE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/FMHRE7PFTBGOLCW7JTDMO6XH2I.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/RQL7BHT6I5CG3NBQ2C4QP43RZA.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/VSVDNUHZ4RCITIAJSPYQ7QL3FI.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/5F2XVHNKNBEJTMRDFFAIKXOL4A.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/YDDKELAKBFDCFMOX6HE64WLATQ.png)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/LW4OJHHVRZBPBO7F7ORVDG4WKA.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/YXUVMYNEOVEVHFFOH3JUQCA2KI.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/DMNCOFDWQZDQ7OCBWH2J3AN7XA.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/LXCRYFRSKNA3FEE3LPWAQFFXAA.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/RVZ73CMTNBBA5EP4HJLO7Q5JCI.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/Z4M4WJ6IHFAVDBL2RLN6DBV7SU.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/CPLFQPIRWJHETP3X25WQJKTWQQ.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/OHX7SX276JETHLHXNRPR6U7JKE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/4H263332KFGUXLH6LNH6FF7QT4.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/UJWEJW3Y7BGZ5PNT5KAGUZYBTI.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/2S6FGSHRWVDE3H3VEV35GNXLYE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/Z46SB6MUIJBJFMHTPOBMIXIZZ4.png)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/C3LTZ5YNNZDSRKOZKTZBJV3U4A.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/CLCJGCR3WBHLNBG56UHAEACZCQ.png)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/NHOMZTHQSBCBNB7FS624L2TQXQ.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/NB4DWF4SCRFGRNY4TEFBD354E4.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/P2WOKB6XCVCMDM2DZOZMLPFV44.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/XPJPMDKGSRCX7JRJQTU55KHMEQ.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/JSAZZC4PNJFDHM4ASMAJ44J7PQ.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/NPEI6LCPDZAORNJKDPAUPJJDW4.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/UCKFUJMKL5HR3OBHCGNDOFAMWE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/ACMGX7PN2JC4FDFI6CKDF5MTDE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/N2RQ45ATD5EMJMG35DAVAQXQXE.jpg)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/G4MJFJW4EZBUDNA6UNR4UYIVOA.JPG)
:format(webp)/cloudfront-us-east-1.images.arcpublishing.com/grupoclarin/PCIYNVPKN5HJ5OJT67MFZFBYX4.png)